Mailling List ini diperuntukan bagi rekan Guru Kimia, dan siapa saja yg perduli dengan pengajaran kimia. Mari bergabung di pengajaran kimia SMA. Kita dapat berbagi pengalaman, keluh kesah dalam pengajaran kimia SMA. Semoga pengajaran Kimia lebih menarik, berkualitas, mudah untuk dipahami semua siswa yg mempelajarinya.
Bahan diskusi utama dalam millis ini yaitu pengajaran materi pelajaran kimia SMA. Di dalamnya diharapkan hanya akan dibahas persoalan pengajaran kimia SMA dan pemecahannya, tips dan trik (kiat) serta alternatif lain dalam penyampaian pelajaran, sehingga mudah diterima dan menarik minat siswa.
Meskipun demikian terbuka juga peluang untuk membahas hal lain yang terkait dengan pengajaran kimia secara umum.
Untuk memudahkan pembacaan diharapkan pada tiap subyek didasarkan per pokok bahasan dengan menuliskan KODE pada bagian awal judul topik.
Stoikiometri = (STK) Struktur Atom = (SA)
Sistem Periodik Unsur2 = (SPU) Ikatan Kimia = (IK)
Termokimia = (TK) Laju Reaksi = (LR)
Kesetimbangan Kimia = (KSK) Larutan = (Lar)
Redoks Elektrokimia = (R&E) Kimia Organik = (KOR)
Kimia Unsur = (KUN) Kimia Koloid = (KKO)
Kimia Lingkungan = (KL) Kimia Inti = (KIN)
BAHASAN UMUM = (UMUM)
Nambahin saja pak urip untuk berbagi sama sama disini.
Konsep atom modern sekarang adalah Inti atom ditengah
dan elektron mengelinginya. Bagaimana lintasan atomnya
? merekal punya kulit kulit tertentu (bilangan kuantum
utama) K, L, M dst. antara satu kulit dan kulit
berikutnya adalah kosong tidak ada elektron yang
melintas. Semakin keluar maka makin jauh dan makin
lemah gaya tarik inti ke elektron tersebut.
Pada tiap kulit ada yang namanya orbital. Orbital ini
adalah sebenarnya tempat lintasan elektron. s, p , d ,
f, dst. Apa yang membedakan s, p , d dan f ini ? yaitu
bentuk lintasannya. kalua s bentuknya bola bisa
ditunjukkan dengan gambar balon. Elekton bukan balonya
tapi permukaan balon itu adalah dimana terdapat
lintasan elektron. Elektron akan bergerak sepanjang
permukaan balon tidak keatasnya tidak kebawahnya.
p berbentuk balon yang diplintir (terpilin dibuku
teks), sebenarnya kita bisa bawa balon kemudian kita
plintir dibagian tengahnya. Nah orbital p ini punya
lintasan seperti permukaan balon yang diplintir
tersebut...Dan lintasannya meliputi 3 arah sumbu x, y,
z sehingga makanya kita tuliskan biasanya 3 kotak.
sedang s dilukiskan 3 kotak. Kalau s menampung 2
elektron maka p menampung 3x2 eletron = 6
demikian juga orbital d, semakin rumit.....ini harus
digambarkan dengan gambar komputer atau gambar real
secara lansung, kalau nggak kesulitan. Tapi biasanya
ini nggak perlu dibahas, tapi anak sudah mengerti
mengenai gambaran lintasan elektron dalam atom. Kalau
mau diteruskan sedikit disini maka harus dijelaskan
dengan gambar posisi posisi orbital (5 posisi)
sehinggal digambarkan 5 kotak ´= isi elektron 5x2 = 10
elektron. Tapi yang ini biasanya bentuknya membikin
bikin bingung siswa, bisa ditinggalkan saja tidak
perlu diberikan, yang penting siswa mengerti kalau
orbital d punya 5 kotak untuk 10 elektron.
JONH DALTON
Pada tahun 1803, John Dalton mengembangkan konsep atom modern pertama. Model Dalton menaruh perhatian utamanya pada sifat kimia atom, yaitu bagaimana atom membentuk senyawa, daripada mencoba untuk menjelaskan sifat fisika atom. Konsep utama dari model Dalton adalah sebagai berikut:
? Sebuah elemen terdiri dari partikel yang sangat kecil dan tidak dapat dibagi lagi disebut atom.
? Semua atom dari elemen tertentu memiliki karakteristik yang identik, yang membedakan mereka dengan atom elemen lain
? Atom tidak dapat diciptakan, dimusnahkan, atau diubah menjadi atom dari elemen lain
? Senyawa terbentuk ketika atom-atom elemen yang berbeda bergabung satu sama lain dalam sebuah rasio tertentu.
? Jumlah dan jenis atom tersebut adalah konstan dalam senyawa tertentu. .
Poin pertama dari teori Dalton berhubungan dengan pengertian orang Yunani tentang atom, yaitu sebuah unit kecil yang bekerja bersama atom lain untuk membentuk senyawa yang lebih besar. Dalton juga mampu untuk memahami tentang adanya sifat elemen yang berbeda-beda dapat dijelaskan dengan bukti adanya berbagai macam atom, yang masing-masing memiliki karakteristik yang berbeda-beda. Poin ke-3 dari model Dalton menunjukkan bahwa atom tidak dapat diubah dengan cara kimia. Ini ditunjukkan dengan bagaimana garam dapat diambil walaupun telah larut dalam air. Poin ke-4 dan ke-5 mendeskripsikan bagaimana atom-atom dapat membentuk senyawa kimia. Konsep-konsep ini secara tepat menjelaskan cara pembentukan senyawa, dan masih digunakan hingga sekarang. Model Dalton, sebagai contoh, dapat menjelaskan bahwa air merupakan senyawa yang berbeda (dengan sifat dan ciri yang berbeda) dari hidrogen hidroksida karena memiliki 1 atom hidrogen lebih sedikit dalam tiap senyawanya daripada yang dimiliki hidrogen hidroksida. Walaupun teori Dalton cukup untuk menjelaskan keberadaan atom, namun struktur atom masih belum dijelaskan dan alasan mengapa elemen yang berbeda memiliki sifat dan ciri yang berbeda masih belum terjawab.
skip to main |
skip to sidebar
WELCOME TO
www.musik-borneo.blogspot.com

CODE EMOTE MY CBOX
Sebelumnya Daus mengucapkan banyak terimakasih pada kalian semua yang telah mengunjungi situs ini.Situs ini sengaja Daus buat dengan tujuan dan upaya agar segala sesuatu yang Daus lakukan dalam bentuk Pesan dan sebagai Media informasi, publikasi maupun komunikasi dan semoga dapat Menjadi pelajaran serta pengetahuan buat kita semua..
Tidak lupa pula Daus mengucapkan Puji Syukur kepada Allah SWT yang telah memberikan rahmat dan hidayah serta talenta/kelebihan untuk Daus agar dapat terus mengembangkan bakat dan kretifitas dalam Melakukan segala hal.Semoga semua Hal yang udah Daus muat di situs sederhana ini bisa bermanfaat bagi kita semua..
NYATA Band - Frustasi.mp3
NYATA Band - Kembalilah Puji.mp3
NYATA Band - Kau Tercipta Bukanlah Untukku.mp3
FACEBOOK
www.musik-borneo.blogspot.com
Login
Please enter your username and password to enter your Blogger Dasboard page!
Widget edited by Đąųş ηýąτą βąηδ
Widget edited by Đąųş ηýąτą βąηδ
Mengenai Saya
- Daus NYATA Band
- Kuburaya,Pontianak, Kalimantan Barat, Indonesia
- Kesempatan Jangan di Tunggu Melainkan di ciptakan..
BUKU TAMU
Pengguna :
Online :
Total :
IP Pengguna :
Đąųş ηýąτą βąηδ
Sebelumnya Daus mengucapkan banyak terimakasih pada kalian semua yang telah mengunjungi situs ini.Situs ini sengaja Daus buat dengan tujuan dan upaya agar segala sesuatu yang Daus lakukan dalam bentuk Pesan dan sebagai Media informasi, publikasi maupun komunikasi dan semoga dapat Menjadi pelajaran serta pengetahuan buat kita semua..
Tidak lupa pula Daus mengucapkan Puji Syukur kepada Allah SWT yang telah memberikan rahmat dan hidayah serta talenta/kelebihan untuk Daus agar dapat terus mengembangkan bakat dan kretifitas dalam Melakukan segala hal.Semoga semua Hal yang udah Daus muat di situs sederhana ini bisa bermanfaat bagi kita semua..
NYATA Band - Frustasi.mp3
NYATA Band - Kembalilah Puji.mp3
NYATA Band - Kau Tercipta Bukanlah Untukku.mp3
ABOUT ME Categories
APPLIKASI SUPPORT NIMBUZZ
Berikan Polling Kalian untuk Situs ini
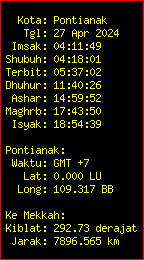
Jadwal Shalat
Arsip Blog
-
▼
2009
(147)
-
▼
April
(96)
-
▼
Apr 27
(38)
- Taksonomi Vertebrata
- Sosialisasi dan Stratifikasi Sosial
- SAP Komputer Dasar
- Virus Bakterial
- Mikroorganisme dan Mikrobiota
- Menambah Pengetahuan Tentang Parasitologi
- Metode Terjemahan dalam Pengajaran Bahasa
- Analisis Sistem Informasi
- PROBLEMA MORFOLOGIS DALAM BAHASA INDONESIA
- Sejarah Filsafat Yunani
- Metode Penelitian Komunikasi
- Mailing List Kimia
- Komunikasi Persuasif dalam Iklan
- KPU Harus Pegang Hasil Hitung Manual
- CINDERELA
- Mengetahui IP Publik Telkom Speedy Anda
- Seks dan Kegunaannya
- Keuntungan Merokok
- Absen FS, YM, FB ,Email, dll Untuk Sanders Seluruh...
- Cara Mempromosiin Blog
- Mp3 Indonesia
- Cara Membuat UltraMP3 Skin dengan UltraMP3 Easy Sk...
- Cara Membuat Kategori / Label di Blog kita
- Mencintai Seseorang Dengan Apa Adanya
- Cara Memasang Game di Profil Friendster
- Pasang Widget Yahoo Pingbox di Friendster
- Cara Membuat Polling di Friendster
- Ngancurin Sebuah Page Secara Bebas
- Cara membuat file javascript dan css untuk fs
- Pasang Jadwal Sholat di Friendster
- Pasang Widget Ayat Al-Quran di Friendster
- Godbye Alert Friendster
- Aplikasi Java Untuk HP
- Kirim Link MP3, Dibayar Rupiah
- Pelajaran dari Ksatria Bergitar
- Eight Ball - Rapper Asal Jogja
- NYARI MELODI GITAR PAKE BANTUAN WINAMP
- Membuat Lagu Ciptaan Sendiri
-
▼
Apr 27
(38)
-
▼
April
(96)
NIMBUZZ
GETJAR
Copyright 2009. Đąųş ηýąτą βąηδ - WPBoxedTech Theme Design by Technology Tricks for ★Đąцş лýąťą Ъąлď★.
Bloggerized by Free Blogger Template - Sponsored by Graphic ZONe and Technology Info
Bloggerized by Free Blogger Template - Sponsored by Graphic ZONe and Technology Info

0 komentar: on "Mailing List Kimia"
Posting Komentar
Mohon Kritik dan Sarannya yah,Terima kasih..
by : Đąųş ηýąτą βąηδ